-
Un article récent du Monde fait le point sur la méthode de vaccination à l'ARN messager.
14 décembre 2020 : le journal Le Monde vient de faire paraître un article sur le fonctionnement des vaccins à ARN messager. J'ai dû stimuler un max mes neurones un peu ramollis par l'âge et faire appel à des souvenirs d'études supérieures datant de l'Empereur pour comprendre cet article long et compliqué mais qui s'avère très intéressant et rassurant.
L'aventure scientifique des vaccins à ARN messager

Lisa Ferdinando. DoD. © Wikimedia Commons
C'est l'histoire d'un concept scientifique qui a débouché, en un temps record, sur le développement et la production à grande échelle de préparations vaccinales qui seront pour la première fois administrées chez l’homme dans un contexte très particulier, celui d’une maladie infectieuse pandémique.
Des millions de doses des vaccins élaborés par Pfizer/BioNTech d’une part, Moderna d’autre part, sont en effet actuellement produites pour répondre à la demande de nombreux pays. Elles ont commencé à être administrées au Royaume-Uni, aux États-Unis, au Canada.
Ces vaccins sont constitués d’ARN (ou acide ribonucléique). Plus précisément, ils renferment une molécule d’ARN messager qui renferme le code génétique de fabrication de l’antigène viral qui sera reconnu par le système immunitaire, lequel protégera l’individu vacciné lors d’un second contact avec l’agent infectieux.
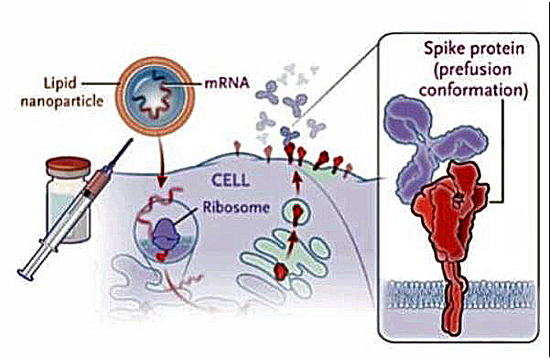
Encapsulation de l’ARN messager (ARNm), codant la protéine Spike du coronavirus SARS-CoV-2, dans une nanoparticule lipidique. L’ARN messager est traduit dans le cytoplasme au niveau des ribosomes en protéine vaccinale. Polack FP, et al. N Engl J Med. 2020 Dec 10.
C’est donc une stratégie vaccinale, jamais employée auparavant en médecine humaine, qui sera donc utilisée pour la première fois dans la lutte contre le SARS-CoV-2, le coronavirus responsable de la Covid-19.
Le vaccin de Pfizer/BioNTech (BNT162b2), comme celui de Moderna (mRNA-1273), repose sur l’injection intramusculaire d’un ARN messager codant la protéine S (Spike) de l’enveloppe du SARS-CoV-2. Il s’agit de la protéine S stabilisée « en conformation pré-fusion », autrement dit dans l’état conformationnel dans laquelle elle se trouve avant que l’enveloppe du virus fusionne avec la membrane de la cellule qu’elle infecte. La protéine S est l’élément de l’enveloppe du SARS-CoV-2 qui reconnaît le récepteur ACE2 présent à la surface des cellules cibles.
La firme allemande CureVac (Tübingen) a également développé un vaccin ARN messager (CVnCoV) contre la Covid-19. Une dose de 12 microgrammes d’ARN messager, encapsulée dans des nanoparticules lipidiques, a été retenue pour un essai de phase II/III qui devrait débuter prochainement.
En Chine, un vaccin ARN messager (ARCoV) a été développé par l’académie militaire de l’Armée populaire de libération, en association avec les sociétés de biotechnologie Suzhou Abogen Biosciences et Walvax Biotechnology.
Ces candidats-vaccins anti-Covid-19, reposent comme tous les autres vaccins dont on dispose, sur un même principe : conférer une protection contre un agent pathogène en en apprenant au système immunitaire à le reconnaître et à le garder en mémoire. Pour ce faire, le vaccin délivre un antigène vaccinal, autrement dit une protéine issue du virus. L’antigène est sélectionné en fonction de son immunogénicité, autrement dit de sa capacité à induire une réponse immunitaire.
Les acteurs de l’immunité vaccinale
Tout d’abord un rappel indispensable sur les fondamentaux en matière d’immunologie de la vaccination. La mise en place d’une mémoire immunitaire nécessite la participation de plusieurs acteurs incontournables et en premier lieu ceux qui vont d’emblée présenter l’antigène vaccinal au système immunitaire. Ce rôle est dévolu aux macrophages, aux monocytes, aux lymphocytes B et surtout aux cellules dendritiques, souvent dénommées cellules présentatrices d’antigènes « professionnelles » (CPA).
Ces cellules CPA présentent à leur surface l’antigène sur un support : le complexe majeur d’histocompatibilité (CMH) de classe II (CMH-II). L’antigène est alors reconnu par une catégorie de globules blancs, les lymphocytes T CD4. Après reconnaissance de l’antigène, les lymphocytes T CD4 vont aider à la différenciation des lymphocytes B en plasmocytes, cellules dont le rôle exclusif est de fabriquer des anticorps, et en cellules B mémoire.
L’immunité vaccinale repose également sur la capacité d’une autre catégorie de lymphocytes, les cellules T CD8, à reconnaître l’antigène vaccinal. Cette reconnaissance implique cette fois le complexe majeur d’histocompatibilité (CMH) de classe I (CMH-I). Après reconnaissance de l’antigène, les lymphocytes T CD8 deviennent des lymphocytes cytotoxiques, autrement dit des cellules « tueuses » capables de détruire les cellules infectées par l’agent infectieux. Cette seconde rencontre avec l’antigène viral déclenchera la mémoire immunitaire (lymphocytes T mémoire).

© FDA
Nouvelle modalité vaccinale
Alors que les vaccins conventionnels consistent à injecter l’antigène à la personne vaccinée, le principe d’un vaccin à ARN est que des cellules de son organisme produisent elles-mêmes cet antigène. Ce sont les cellules présentatrices d’antigène (CPA) qui vont elles-mêmes fabriquer l’antigène avant de le présenter au système immunitaire. Si ces cellules synthétisent l’antigène vaccinal, c’est parce qu’on leur donne les instructions pour le faire, autrement dit qu’on leur délivre directement le code génétique de fabrication du vaccin.
Là encore, un petit rappel de biochimie cellulaire s’impose. Pour synthétiser des protéines, une cellule doit convertir dans son noyau une portion de son ADN (gène) en ARN. L’information génétique contenue dans l’ADN est d’abord copiée dans le noyau sous forme d’ARN. Cette étape est appelée transcription. Après avoir subi une maturation, l’ARN est exporté dans le cytoplasme. Cette molécule d’ARN véhicule le message permettant la synthèse des protéines, raison pour laquelle on lui a donné le nom d’ARN messager (ARNm).
Les molécules d’ARN messager parviennent dans le cytoplasme au niveau de structures appelées ribosomes, qui assurent le décodage de l’information génétique portée par les ARN messagers en même temps qu’ils participent à la synthèse des protéines, composées d’unités élémentaires : les acides aminés. Au sein du code génétique de l’ARN messager, chaque série de trois lettres (appelés triplets de nucléotides ou codons) correspond à un acide aminé. La synthèse des protéines est également appelée traduction. On dit que les ARN messagers sont traduits.
Une saga qui remonte au début des années 1990
Comment en est-on arrivé à concevoir des vaccins à ARN messager dirigeant la synthèse d’une protéine étrangère dans certaines cellules chez l’individu vacciné ?
En 1989, une société californienne de biotechnologie, Vical, basée à San Diego, rapporte avoir réussi à inclure un ARN messager dans une nanoparticule lipidique et à introduire celle-ci dans plusieurs types de cellules.
Ce n’est cependant que quelques mois plus tard, en 1990, que l’histoire des vaccins à ARN débute véritablement. Jon A. Wolff et ses collègues de l’université du Wisconsin montrent, dans un article publié dans la revue Science, que l’on peut exprimer in vivo chez la souris un ARN messager (non modifié, non protégé) après injection directe dans le muscle. Ces chercheurs montrent alors, pour la première fois, qu’il est possible de faire en sorte que des cellules vivantes ayant capté un ARN se mettent à suivre les instructions génétiques portées par cette molécule et fabriquer la protéine correspondante pendant quelques jours.
Il existe cependant une énorme différence entre les vaccins à ADN et ARN. Contrairement à un vaccin à ADN, un vaccin à ARN n’a pas besoin de pénétrer dans le noyau de la cellule. Une fois dans le cytoplasme de la cellule, il peut être immédiatement traduit en protéine.

Les éléments constitutifs d’un ARN messager codant une protéine d’intérêt. Les extrémités sont représentés par une coiffe et une queue poly-A. Jackson NAC, et al. NPJ Vaccines. 2020 Feb 4;5:11.
Les quatre composants d’un ARN messager
Les quatre composants d’un ARN messager vaccinal sont, comme le montre l’illustration ci-dessus : la coiffe 5 (5’ cap), les séquences régulatrices UTR flanquant de part et d’autre la séquence codante d’un gène d’intérêt (antigène vaccinal), la queue poly-A (3’ Poly-A-tail). Cette dernière est constituée d’une séquence répétée (polyadénosine) qui augmente sa stabilité. La coiffe et la queue sont des structures cruciales dans la mesure où elles permettent l’accès de la molécule d’ARN messager aux ribosomes, autrement dit à la machinerie cellulaire qui entraîne la production de la protéine d’intérêt.
La production d’un ARN synthétique commence avec un ADN
Connaissant la structure primaire de l’antigène vaccinal, autrement dit la composition précise en acides aminés de la protéine contre laquelle on veut vacciner, on en déduit la séquence ADN qui lui correspond. C’est à partir de cet ADN que l’on produit l’ARN in vitro, en dehors de toute cellule. Les réactions biochimiques ont donc lieu dans un système acellulaire, ce qui facilite leur production et exclut tout risque de contamination par un éventuel agent infectieux intracellulaire (bactérie, virus).
L’ARN messager provient de la transcription in vitro d’un ADN circulaire (ADN plasmidique codant l’antigène vaccinal), préalablement linéarisé. Sahin U, Karikó K, Türeci Ö. Nat Rev Drug Discov. 2014 Oct;13(10):759-80.
La formation de la molécule d’ARN résulte donc d’une réaction in vitro. Celle-ci a pour point de départ une molécule d’ADN circulaire, appelée ADN plasmidique, que l’on linéarise. Le brin d’ARN synthétique que l’on cherche à fabriquer sera la copie complémentaire de cet ADN plasmidique devenu linéaire. La réaction nécessite la présence d’une enzyme et de nucléotides (lettres de l’alphabet génétique, composants essentiels de toute molécule d’ARN). L’enzyme ARN polymérase copie alors l’ADN en utilisant les nucléotides.
L’ARN messager synthétique produit est donc le résultat d’une transcription in vitro à partir d’un ADN circulaire. Une coiffe peut être ajoutée par voie enzymatique une fois la réaction terminée. Il est également possible qu’un analogue de coiffe synthétique soit synthétisé au cours même de la procédure. Enfin, une séquence terminale est ajoutée afin de construire un ARN messager complet.
Travaux pionniers sur la grippe et le cancer
En 1994, X. Zhou, Peter Berglund, Peter Liljeström et leurs collègues de l’Institut Karolinska (Stockholm) rapportent dans la revue Vaccine que l’injection intramusculaire de 50 microgrammes d’ARN (nu, c’est-à-dire non modifié) provenant du virus de la forêt de Semliki (SFV) et codant une protéine (nucléoprotéine) du virus de la grippe induit une réponse spécifique en anticorps chez la souris.
En 1999, Han Ying et ses collègues du National Cancer Institute (États-Unis) montrent dans la revue Nature Medicine être parvenu à induire une réponse humorale (en anticorps) et cellulaire (en lymphocytes T) en administrant par voie intramusculaire à des souris seulement 0,1 microgramme d’un ARN de SFV codant une protéine (bêta-galactosidase). Cette immunisation se révèle capable de protéger des souris de l’injection de cellules tumorales de côlon exprimant la bêta-galactosidase.
Avancées scientifiques et technologiques
Malgré ces premiers succès, la recherche vaccinale concerne principalement les vaccins à ADN jusqu’à la fin des années 2000. En effet, les travaux sur les vaccins à ARN font face aux problèmes liés à la stabilité de l’ARN et se heurtent à la nécessité d’inventer des méthodes pour délivrer efficacement l’acide nucléique dans les cellules, mais également au fait que l’ARN possède la capacité intrinsèque à stimuler le système immunitaire. Ce puissant effet immunogène inhérent à l’ARN peut entraîner d’importantes réactions inflammatoires. Dernier obstacle majeur : fabriquer en grandes quantités de l’ARN messager n’est pas chose aisée.
Ce n’est que ces dix dernières années que ces questions ont été largement résolues grâce à des innovations concernant l’incorporation des nucléotides. Les chercheurs ont en effet eu recours à des nucléotides modifiés (toutes les uridines sont remplacées par une pseudo-uridine). De même, ils ont procédé à l’optimisation des séquences génétiques. En effet, les codons rares (groupe de trois lettres dans la séquence génétique initiale) sont remplacés par des codons synonymes, mais plus fréquemment utilisés, ce qui permet d’augmenter l’expression de la protéine vaccinale.
Enfin, il importe de réaliser une purification des ARN messagers. En effet, il apparaît nécessaire d’éliminer certains contaminants, premièrement des ARN double brin mais également des brins d’ARN avec boucle, qui peuvent se former au cours de la réaction in vitro durant laquelle les ARN messagers sont produits. Des techniques de pointe (chromatographie à haute performance ou chromatographie liquide protéique rapide) sont utilisées pour se débarrasser de ces sous-produits contaminants.
L’équipe de Katalin Karikó, alors à l’université de Pennsylvanie (Philadelphie), s’illustre alors dans le développement de solutions scientifiques et technologiques innovantes concernant l’incorporation de nucléotides modifiés et le retrait des contaminants. Ces avancées, souvent menées conjointement avec Drew Weissman, visent à ce que la molécule d’ARN ne stimule pas de façon inappropriée l’immunité innée, première ligne de défense du système immunitaire permettant de rapidement identifier les signaux dangereux provenant d’agents pathogènes extérieurs.
Systèmes de livraison de l’ARN messager
Par ailleurs, le développement de cette nouvelle génération de vaccins nécessite évidemment d’avoir recours à des technologies visant à amener la molécule d’ARN à bon port, à savoir dans le cytoplasme de la cellule.
La première difficulté est donc de faire en sorte que l’ARN messager pénètre dans les cellules du tissu (peau, muscle) dans lequel on l’injecte. Il faut donc que la molécule d’ARN franchisse la membrane cellulaire afin de se retrouver dans le cytoplasme. C’est en effet dans ce compartiment de la cellule qu’elle sera traduite en protéine et servira d’antigène vaccinal.
Or la membrane de la cellule, constituée d’une double couche de lipides chargés négativement, constitue un obstacle physique majeur à l’entrée d’une molécule dans le milieu intracellulaire. De plus, plusieurs pompes et canaux ioniques créent un potentiel négatif (-40 à -80 mV) de part et d’autre de la membrane et maintiennent une charge électrique négative dans le cytoplasme. Ce potentiel négatif crée une barrière au passage des molécules d’ARN elles-mêmes chargées négativement.
Par ailleurs, l’ARN est constamment menacé d’être dégradé par des enzymes, des ribonucléases extracellulaires [1], abondamment présentes dans la peau et dans le sang. Cela impose donc de protéger l’ARN messager, menacé d’être détruit par ces enzymes ubiquitaires, tout en facilitant sa pénétration dans la cellule.
Représentation schématique de multiples formulations de nanoparticules lipidiques servant de système de livraison de l’ARN messager : lipides ionisables, lipides cationiques, co-lipides (lipides helper), polymères, etc. Zhong Z, et al. Nanotoday. 2018 Dec;23:16-39.
Un moyen efficace pour protéger l’ARN consiste à l’encapsuler dans de très petites particules, en l’occurrence des nanoparticules lipidiques. Celles-ci sont typiquement composées de quatre éléments différents. Tout d’abord de lipides capables de s’auto-agencer en particules sphériques (de 70–100 nanomètres) pour encapsuler l’ARN messager, soit ionisables (capables d’acquérir des charges positives en fonction du pH) ou cationiques (chargés positivement). Ensuite de phospholipides ressemblant à ceux de la membrane cellulaire. Mais aussi de cholestérol qui stabilise la double couche lipidique de la nanoparticule lipidique. Enfin d’un lipide-PEG (polyéthylène glycol) qui apporte une couche hydratée aux nanoparticules et permet à ces formulations de gagner en stabilité.
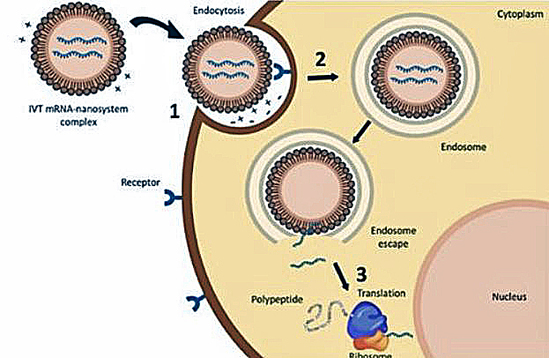
Les nanoparticules lipidiques encapsulant l’ARN messager pénètrent dans la cellule par endocytose. La membrane externe enveloppe et absorbe la vésicule lipidique, la faisant entrer dans le cytoplasme. L’ARN messager gagne un endosome. Il s’en échappe pour ensuite être lu au niveau des ribosomes et traduit en protéine. Gómez-Aguado I, et al. Nanomaterials (Basel). 2020 Feb 20;10(2):364.
Une fois dans le cytoplasme, les nanoparticules lipidiques sont acheminées vers des endosomes et lysosomes, de petites structures sphériques en forme de vésicules dans lesquelles une partie de l’ARN messager est dégradée. Une partie parvient cependant à s’en échapper et évite la dégradation par des mécanismes complexes non encore parfaitement élucidés.
Représentation schématique de l’injection intracellulaire d’un ARN messager (ARNm) encapsulé dans une nanoparticule lipidique composée de lipides ionisables, de lipides helper (co-lipides) et de cholestérol. Kowalski PS, et al. Mol Ther. 2019 Apr 10;27(4):710-728.
Les matériaux utilisés pour délivrer la molécule d’ARN messager portant le code de fabrication de l’antigène vaccinal dans la cellule ont fait l’objet d’intenses recherches ces dernières années. Elles ont enfin vu l’avènement de technologies très efficaces permettant de grandement améliorer la délivrance de l’ARN messager.
À côté des lipides ionisables, des travaux ont été menés sur des matériaux polymères biodégradables ramifiés, composés d’acides gras branchés ou hyperbranchés. Ces structures aux multiples ramifications permettraient aux nanoparticules lipidiques de gagner en stabilité tout en leur permettant de s’échapper plus facilement des endosomes une fois à l’intérieur de la cellule.
De fait, les lipides complexes et autres excipients qui composent les nanoparticules lipidiques ont fait l’objet d’intenses recherches des dernières années. Des chercheurs américains ont ainsi développé des moyens pour délivrer l’ARN messager dans la cellule par l’intermédiaire de dendrimères, qui sont des structures composées de multiples acides gras ramifiés et dont la forme générale ressemble aux branches d’un arbre. Enfin, d’autres équipes ont créé des peptides qui, greffés à l’ARN messager, facilitent sa captation par la membrane externe de la cellule qui, en se creusant progressivement, lui permet de pénétrer dans le cytoplasme.
L’imagination n’a pas de limite lorsqu’il s’agit de développer le moyen le plus efficace pour faire entrer les précieuses molécules d’ARN messager dans des cellules. Des sociétés de biotechnologie (BioNTech) ont développé leurs propres formulations tandis des groupes pharmaceutiques se les procurent auprès d’autres firmes (Acuitas, Moderna, Precision).
ARN messager conventionnel ou auto-réplicatif
Il existe deux sortes de vaccins à ARN messager. Le premier repose sur un ARN conventionnel.

ARN dit « conventionnel » (non-amplifiant), avec à ses extrémités une coiffe et une queue poly-A. Zhong Z, et al. 2018 Dec;23:16-39.
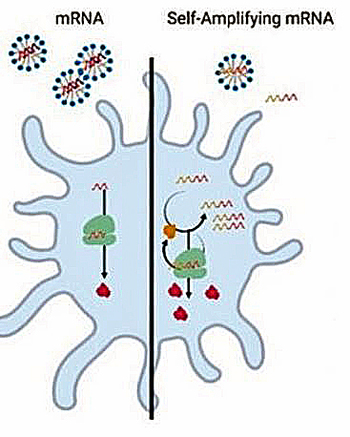
Le second consiste en un ARN messager dit auto-réplicatif (self-amplifying mRNA). L’objectif de ces derniers est de démultiplier le nombre de molécules d’ARN messager qui seront traduites en protéines dans le cytoplasme de la cellule.

Représentation schématique d’un vaccin à ARN auto-réplicatif. Celui-ci renferme la séquence codant l’antigène d’intérêt (en violet, GOI : gene of interest) ainsi qu’une séquence codant des protéines non structurales participant à la réplication de l’ARN. Cette machinerie de réplication, appelée complexe réplicase, provient le plus souvent d’un alphavirus ou d’un flavivirus. Il peut s’agir du virus Sindbis, de celui de la forêt de Semliki ou du virus Kunjin. Le complexe réplicase est composé de quatre gènes non structuraux (nsP1, nsP2, nsP3, nsP4). SP : protéines structurales. Versteeg L, et al. Vaccines (Basel). 2019 Sep 20;7(4):122.
Les vaccins à ARN auto-réplicatif ont la particularité de renfermer une séquence d’un alphavirus ou d’un flavivirus. Ces virus possèdent un ARN qui a la capacité de s’autorépliquer car il code une enzyme appelée réplicase. La séquence du virus codant les protéines structurales est en revanche remplacée par celle codant l’antigène vaccinal. L’absence quasi-totale de protéines virales structurales empêche la production de particules virales infectieuses correspondant au virus d’origine. L’ARN synthétique qui en résulte est appelé réplicon.
Schéma illustrant une cellule après introduction d’un vaccin à ARN messager conventionnel (à gauche) ou d’un ARNm auto-réplicatif (à droite). Rendement supérieur de la protéine traduite via le processus d’auto-réplication de l’ARN. Versteeg L, et al. Vaccines (Basel). 2019 Sep 20;7(4):122.
Une fois parvenu dans le cytoplasme de la cellule, l’ARN auto-réplicatif traduit le gène de la réplicase. Cette enzyme copie alors la longue molécule d’ARN en un brin complémentaire. Celui-ci est ensuite utilisé par la réplicase pour fabriquer une grande quantité d’ARN auto-réplicatif. Dans le même temps, la réplicase se fixe sur le brin ARN négatif et commence à reproduire de multiples copies de l’ARN codant la protéine d’intérêt. Cet ARN messager (ou réplicon), porteur du code de fabrication de l’antigène vaccinal, est alors copié de nombreuses fois. Ces multiples molécules d’ARN messager sont ensuite lues par les ribosomes qui synthétisent une grande quantité d’antigène vaccinal.
Représentation schématique des deux sortes de vaccins à ARN messager (mRNA). À gauche : vaccin à ARN messager dit « conventionnel », par opposition au vaccin à ARN auto-réplicatif (à droite). Une fois la protéine synthétisée au niveau des ribosomes, elle est présentée au niveau de la membrane externe de la cellule, sous la forme de fragments. Ce sont ces derniers, portés par les molécules du complexe majeur d’histocompatibilité (CMH), qui sont reconnus par le système immunitaire. En violet, GOI: gene of interest (gène d’intérêt codant l’antigène vaccinal). Maruggi G, et al. Mol Ther. 2019 Apr 10;27(4):757-772.
Par rapport aux ARN non-réplicatifs, les vaccins ARN auto-réplicatifs ont pour principal avantage de prolonger la durée durant laquelle la protéine pour laquelle ils codent est produite.
Jusqu’à ce jour, ces ARN messagers auto-réplicatifs n’ont été testés que sur des modèles animaux. La durée d’expression de la protéine vaccinale est, selon les cas, de plusieurs jours, plusieurs semaines, jusqu’à deux mois. Afin de conserver leur capacité d’auto-amplification, ces réplicons ARN ne sont pas capables, contrairement à leurs homologues non-réplicatifs, d’accepter des modifications de nucléotides et autres modifications de séquences. Les ARN auto-réplicatifs sont plus longs que les autres (9 000 à 10 000 paires de bases contre 2 000 à 3 000 bases). Dans certains modèles animaux, les vaccins à ARN messager auto-réplicatif permettent de conférer une protection équivalente aux vaccins à ARN messager conventionnel mais à des doses nettement inférieures.
Le premier article décrivant l’utilisation de nanoparticules pour délivrer un ARN auto-réplicatif a été publié par des chercheurs de la firme pharmaceutique Novartis en 2012 dans les comptes rendus de l’Académie américaine des sciences (PNAS). Andrew J. Geall et ses collègues rapportaient avoir induit une réponse immunitaire contre le virus de la grippe et le parasite de la toxoplasmose.
Sur la piste de l’ARN auto-réplicatif
Aujourd’hui, plusieurs équipes travaillent à la mise au point d’un vaccin anti-Covid-19 reposant sur l’emploi d’un ARN messager auto-amplifiant. Cette stratégie est développée à l’Imperial College de Londres. Elle repose sur un ARN auto-réplicatif utilisant le génome du virus VEEV (virus de l’encéphalite équine vénézuélienne) codant la protéine Spike (spicule) de l’enveloppe du SARS-CoV-2.
Cet ARN messager est encapsulé dans des nanoparticules lipidiques. Une étude publiée en juillet 2020 dans la revue Nature Communications a montré que ce vaccin prototype entraînait chez la souris la production robuste d’anticorps neutralisants spécifiques ainsi qu’une réponse cellulaire immunitaire. Les chercheurs précisent par ailleurs ne pas avoir observé la production in vitro d’anticorps facilitants, via un phénomène baptisé ADE (antibody-dependent enhancement). Il convient en effet de s’assurer en laboratoire que certains anticorps non neutralisants ne facilitent pas la pénétration du virus dans les cellules. Cet ARN messager auto-réplicatif codant la protéine Spike du SARS-CoV-2 est en essai clinique de phase I dans le but d’évaluer sa sécurité chez des volontaires sains.
BioNTech, en partenariat avec Pfizer, a également développé un vaccin prototype anti-Covid-19 reposant sur l’utilisation d’un ARN messager auto-réplicatif codant la protéine Spike du SARS-CoV-2. On ignore l’origine de l’ARN viral et la composition du système de livraison de ce futur ARN messager auto-réplicatif.
Un autre candidat vaccin à ARN messager auto-réplicatif a été développé par la société américaine de biotechnologie HDT Bio Corp. (Seattle). Il s’agit d’un ARN du virus VEEV, exprimant la protéine Spike du SARS-CoV-2, encapsulé dans des nanoparticules lipidiques. Ce vaccin s’est montré capable d’induire des anticorps neutralisants chez des souris âgées et des primates non humains (singes) pendant au moins 70 jours.
Acturus, firme basée à Singapour, a développé un ARNm auto-réplicatif codant la protéine Skipe du SARS-CoV-2 et qui est en essai clinique de phase I.
Bientôt des vaccins ARN « trans » ?
Outre les ARN messagers, tout juste sortis des laboratoires mais déjà qualifiés de conventionnels, et les ARN auto-réplicatifs, encore au stade expérimental, des équipes travaillent à la mise au point d’un troisième format d’ARN messager : le transréplicon (trans-amplifying RNA ou taRNA).

Représentation schématique d’un vaccin à ARN messager trans-amplifiant, composé de deux brins d’ARN. Un brin d’ARN porte la machinerie d’autoréplication provenant d’un alphavirus, tandis que le second brin d’ARN code l’antigène vaccinal. Bloom K, van den Berg F, Arbuthnot P. Gene Ther. 2020 Oct 22:1–13.
Cette méthode est bipartite. Elle repose sur un brin ARN codant la réplicase et un second codant la protéine d’intérêt. Le système se compose d’un ARN auto-réplicatif dont la séquence correspondant à la réplicase a été supprimée pour être positionnée sur un autre ARN (ARN messager conventionnel ou ARN auto-réplicatif). La machinerie d’autoréplication ne se trouve donc pas sur l’ARN qui code l’antigène vaccinal mais sur un second brin d’ARN (en position « trans », dans le jargon des biologistes moléculaires).
Le transréplicon permet la production de l’antigène à un taux 10 à 100 fois supérieur à celui que permet un simple ARN non conventionnel, mais pas encore à celui qui est obtenu via un ARN messager auto-réplicatif.
Chez la souris, ce système s’est récemment montré très efficace contre le virus grippal, à une dose de 50 nanogrammes d’antigène vaccinal (hémagglutinine du virus influenza), pour induire une importante réponse en anticorps neutralisants et conférer une réponse immunitaire protectrice vis-à-vis du virus grippal, et ce même sans utiliser de particules nanolipidiques ou tout autre système de livraison de l’ARN.
Des ARN trans-amplifiants ont été administrés aux rongeurs dans une simple solution saline. Si cette approche expérimentale était validée, cette stratégie, constituerait un atout dans la mesure où cela permettrait de réduire la quantité de vaccin à administrer. On parle ici d’« épargne de dose », un même effet immunitaire pouvant être généré par une plus faible dose.
C’est curieusement la plus faible dose d’ARN (50 ng versus 250 ng) qui s’est montrée la plus efficace après injection intradermique pour induire une réponse robuste en anticorps chez la souris. Publiée en janvier 2020 dans la revue Molecular Therapy, cette étude est la première à utiliser un vaccin trans-amplifiant. Elle a été conduite par des chercheurs allemands de l’université de Mayence, en collaboration avec la société de biotechnologie BioNTech.
Ces résultats encourageants laissent entrevoir la possibilité d’utiliser de très faibles doses d’ARN non formulé (c’est-à-dire non protégé dans un système de livraison), ce qui réduirait encore les coûts de production de ce type de vaccin. Le fait que la réplicase ne soit plus codée sur le même brin d’ARN que celui qui code l’antigène vaccinal permet de raccourcir le second brin. Cela simplifie d’autant la fabrication des ARN, la production de longues molécules d’ARN in vitro représentant un défi technique. Surtout, il devient possible de fabriquer à l’avance des ARN porteurs de la séquence codant la réplicase, ce brin d’ARN demeurant inchangé quel que soit le vaccin à ARN messager utilisé.
Par ailleurs, ce système gagne encore en sécurité. En effet, il devient théoriquement encore plus difficile pour deux brins d’ARN situés dans le cytoplasme de la cellule de pénétrer dans le noyau. Nous reviendrons sur cette question un peu plus tard.
La sécurité est également améliorée dans la mesure où il est théoriquement possible que la protéine une fois produite dans le cytoplasme puisse elle-même envelopper l’ARN messager qui a servi à sa synthèse. Publiés dans la revue Cell en 1994, des travaux ont en effet montré que la volumineuse protéine de surface du virus de la stomatite vésiculeuse (VSV) était capable de totalement envelopper l’ARN viral, jusqu’à former des vésicules se comportant comme des particules infectieuses. Même si ces pseudoparticules virales ne contiennent que l’ARN qui a servi à la production de leur enveloppe et ne renferment donc pas la totalité de l’ARN du virus d’origine, elles peuvent se comporter comme des particules infectieuses. En effet, le risque existe que ces particules trouvent une voie de sortie de la cellule (via des vésicules qui se déversent naturellement dans l’espace extracellulaire) et finissent par pénétrer dans de nouvelles cellules.
Ce risque potentiel serait réduit si l’on avait recours non pas à un, mais à deux ARN messagers, font remarquer Deborah H. Fuller et Peter Berglund, chercheurs à la Faculté de médecine de l’université Washington (Seattle). Ces deux experts commentaient, dans un article paru en juin 2020 dans le New England Journal of Medicine, les atouts d’un nouvel ARN trans-amplifiant.
ARN messager et immunité innée
Une fois injecté dans l’organisme, l’ARN est capté par des cellules qui assurent la première ligne de défense du système immunitaire, ce qu’on appelle les cellules de l’immunité innée, notamment les macrophages et les cellules dendritiques.
Les cellules dendritiques font partie des cellules présentatrices « professionnelles » de l’antigène. Comme cette expression le souligne, ces cellules sont particulièrement bien équipées pour présenter l’antigène (l’intrus) à diverses catégories de globules blancs (lymphocytes T) pour dans un second temps induire la réponse immunitaire dite adaptative. À ce titre, les cellules présentatrices d’antigène constituent donc un maillon essentiel dans le développement de la réponse immunitaire induite par la vaccination.
Le rôle « professionnel » d’une cellule dendritique est de détecter l’antigène, le faire pénétrer dans son cytoplasme, le découper en fragments et de présenter ceux-ci à sa surface. Celui-ci est alors exposé sur la membrane externe de la cellule par l’intermédiaire des molécules de classe I et II du complexe majeur d’histocompatibilité (CMH) afin qu’ils puissent activer des lymphocytes T (CD4 et CD8) ne l’ayant jamais rencontré (lymphocytes naïfs). Dörrie J, et al. Pharmaceutics. 2020 Jan 23;12(2):92.
L’ARN induit intrinsèquement une stimulation immunitaire
L’ARN messager contenu dans le vaccin ressemble à un véritable ARN viral et stimule des « capteurs de danger », qui appartiennent à une famille de récepteurs de reconnaissance de motifs moléculaires du pathogène (Pattern Recognition Receptors, PRR).
En effet, pour répondre efficacement à une menace, les cellules de l’immunité innée sont capables d’identifier des signaux provenant de pathogènes extérieurs. Pour ce faire, elles reconnaissent des motifs moléculaires associés aux pathogènes par l’intermédiaire de ces récepteurs PRR. Ceux-ci sont exprimés à la surface de la cellules ou dans les endosomes des cellules présentatrices d’antigène. L’ARN messager peut également se lier à d’autres capteurs de danger localisés dans le cytoplasme (RIG-1 et MDA5). L’activation de ces molécules provoque la maturation des cellules présentatrices d’antigène et active la sécrétion de molécules associées à l’inflammation (cytokines inflammatoires).
Cette stimulation de cellules de l’immunité innée peut améliorer l’efficacité du vaccin. Cela dit, une activation qui dépasse son but peut provoquer la dégradation de l’ARN messager et donc réduire l’expression de l’antigène vaccinal.
L’interféron, arme à double tranchant
Le déclenchement de l’immunité innée (provoquée par les capteurs de danger que sont les PRR) se traduit par la production précoce et importante d’interféron (IFN-1). Alors que l’activation équilibrée d’interféron est bénéfique pour générer une réaction immunitaire efficace, une réponse en interféron excessive empêche l’expression de l’ARN messager vaccinal.
En effet, l’interféron s’avère nécessaire pour que les lymphocytes T CD8 activés par l’antigène deviennent des lymphocytes cytotoxiques (« tueurs ») s’ils devaient rencontrer le véritable virus. Produit en très grande quantité, l’interféron peut également épuiser ces mêmes cellules.
L’action stimulante, ou à l’inverse inhibitrice, de l’interféron (IFN-1) sur les lymphocytes T CD8 semble dépendre du moment où il est produit et de l’intensité de sa production. Tout serait une question de chronologie. Si l’activation des lymphocytes T coïncidait et précèdait de peu l’action de l’interféron, l’action de l’ARN messager faciliterait la réponse immunitaire. Dans le cas contraire, l’interféron limiterait l’activité des lymphocytes T.
Il semble donc que l’interféron peut soit augmenter, soit inhiber l’immunité protectrice. Un moyen de réduire une réponse inadaptée de l’immunité innée (via une production accrue d’interféron), qui pourrait limiter l’intensité et la durée de production de la protéine vaccinale, serait d’administrer conjointement à l’ARN des protéines inhibitrices de la réponse à l’interféron.

Injection par voie intramusculaire. Daniel Paquet. © Wikimedia Commons
Importance de la voie d’administration
Le système permettant de délivrer l’ARN messager n’est cependant pas le seul paramètre à considérer en termes d’efficacité d’un vaccin à ARN messager. La voie d’administration s’avère également cruciale pour ce qui concerne la captation de l’ARN messager et donc la production de l’antigène vaccinal par les cellules. On sait que les vaccins sont classiquement administrés par voie intradermique, intramusculaire ou sous-cutanée.
Il a été montré, chez des souris, après injection d’un vaccin à ARN messager encapsulé dans des nanoparticules lipidiques que la production de l’antigène est plus forte et plus longue lorsque la préparation vaccinale est administrée par voie intramusculaire ou intradermique. Plus précisément, même si ces deux voies d’administration induisent des taux protecteurs en anticorps chez des primates non humains (singes), les réponses surviennent plus rapidement après administration par voie intradermique.
Cibler l’ARN messager dans les cellules dendritiques
De même, des recherches ont récemment été menées chez la souris pour concevoir des formulations d’ARN messager auto-réplicatif capable de recruter sur le site d’injection intramusculaire des cellules présentatrices d’antigène, afin qu’elles intègrent directement l’ARN messager. Il s’agit de cibler les cellules dendritiques, qui jouent un rôle central dans la présentation de l’antigène vaccinal et donc dans l’initiation de la réponse immunitaire protectrice que l’on cherche à induire.
Afin d’augmenter la captation de l’ARN messager dans les cellules dendritiques, sa libération dans le cytoplasme et sa traduction en protéine, des équipes de recherche ont mis au point des lipides cationiques et des lipoplexes. Ces derniers sont des vésicules lipidiques de composition beaucoup plus complexe que celle d’un simple liposome.
Chez l’animal, des lipoplexes contenant des ARN messagers auto-réplicatifs codant un antigène du virus de la grippe (nucléoprotéine) ont permis de générer des réponses humorale (production d’anticorps) et cellulaire (activation de lymphocytes T) après vaccination sous-cutanée. Le ciblage des cellules dendritiques n’en est qu’à ses débuts.
 fernandozhiminaicela. © Pixabay
fernandozhiminaicela. © PixabayMode d’action des vaccins à ARN
Mais que se passe-t-il après injection d’un vaccin à ARN messager ? Une étude sur la souris, publiée en 2015 dans la revue Immunology, a montré qu’après injection intramusculaire d’un ARN messager auto-réplicatif l’antigène pouvait être exprimé par des cellules musculaires puis être capté par des cellules présentatrices d’antigène qui migrent vers elles. Certaines cellules dendritiques disposent d’une capacité unique, nommée « cross-presentation », qui leur permet de capter un antigène d’origine extracellulaire (provenant donc des cellules musculaires) et de le présenter sur leur surface. L’antigène recruté localement par les cellules dendritiques serait alors reconnu par le système immunitaire, en l’occurrence par des lymphocytes T CD8 dont il provoquerait l’activation.
Cela dit, quand bien même l’ARN messager parviendrait à pénétrer dans des cellules musculaires, il semble bien que le mode d’action d’un vaccin à ARN messager repose principalement, sinon essentiellement, sur les cellules dendritiques dont le rôle clé est de présenter l’antigène au système immunitaire, et qui ont de surcroît la capacité de migrer du site d’injection vers les ganglions lymphatiques situés à proximité (ganglions lymphatiques drainants). Ces ganglions sont extrêmement riches en lymphocytes B et T.
De récentes études chez l’animal (souris, singes macaques rhésus) ont montré qu’une vaccination par ARN messager (avec nucléotides modifiés et encapsulés dans des nanoparticules lipidiques) induit à la fois des taux élevés d’anticorps et des réponses en lymphocytes B et en lymphocytes T folliculaires helper (Tfh) dans les ganglions lymphatiques. Or on sait que les lymphocytes Tfh interagissent dans les centres germinatifs des ganglions lymphatiques avec des lymphocytes B activés pour promouvoir la production robuste d’anticorps neutralisants.
Des études chez la souris ont montré que l’ARN messager administré dans la peau est transporté par des cellules dendritiques migratrices vers les ganglions lymphatiques drainants le territoire correspondant au site d’injection. De fait, il semble bien que ce sont les cellules dendritiques qui captent l’ARN messager et expriment l’antigène vaccinal afin de le présenter à leur surface, à l’intérieur des ganglions lymphatiques. La reconnaissance de l’antigène par les lymphocytes T entraîne leur activation et leur prolifération, point de départ de la réponse immunitaire.
Par ailleurs, des travaux récents ont montré que l’injection intramusculaire chez la souris d’un vaccin à ARN messager formulé dans des nanoparticules lipidiques entraîne une production transitoire et importante de la protéine dans des cellules dendritiques résidant au sein du tissu musculaire.
Le rôle des cellules présentatrices d’antigène a également été mis en évidence chez des singes macaques rhésus, après administration intramusculaire ou intradermique d’un vaccin à ARN messager. L’administration du vaccin a entraîné l’infiltration de cellules immunitaires (neutrophiles, monocytes, cellules dendritiques) sur le site d’injection et à l’intérieur des ganglions lymphatiques drainants. Là encore, ce sont les cellules dendritiques (et les monocytes) qui ont capté l’ARN messager et exprimé la protéine, ce qui a provoqué l’activation de lymphocytes T CD4 spécifiques dans les ganglions lymphatiques situés à proximité.
L’ensemble de ces résultats montre donc le rôle central que jouent les cellules dendritiques dans l’induction d’une réponse spécifique par le système immunitaire.
Le fait qu’un vaccin à ARN entraîne une réponse immunitaire plus rapide après administration intradermique qu’après une injection intramusculaire pourrait tenir au fait que les cellules dendritiques sont plus nombreuses dans la peau que dans le muscle. En effet, le derme est richement pourvu en cellules présentatrices d’antigènes et renferme notamment plusieurs sous-populations de cellules dendritiques. Le muscle est en revanche principalement composé de fibres musculaires et ne compte qu’un petit nombre cellules immunitaires, notamment de rares cellules dendritiques.
L’administration intramusculaire d’un vaccin est généralement effectuée au niveau de l’épaule, dans le muscle deltoïde, parfois dans le muscle fessier ou au niveau de la cuisse (dans le muscle vaste externe). Cette voie d’administration est celle qui est classiquement utilisée pour la quasi-totalité des vaccins. C’est d’ailleurs celle qui a été retenue pour les vaccins à ARN messager anti-Covid-19 développés par les firmes Pfizer/BioNTech et Moderna.
Le fait que les voies intramusculaire et sous cutanée soient les deux principales voies d’administration de vaccins chez l’homme tient surtout au fait que ces deux modalités d’injection sont à la fois simples à réaliser et tout autant efficaces.
Les cellules dendritiques ont la particularité de présenter à leur surface l’antigène sur deux supports différents que sont les molécules du complexe d’histocompatibilité de classe I et II. Cela leur permet de stimuler respectivement les lymphocytes T CD8 et CD4. Par ailleurs, l’antigène, une fois produit par les cellules dendritiques, est sécrété dans le milieu extracellulaire. Alors considéré comme un intrus, il est reconnu par les lymphocytes B qui se mettent à produire des anticorps dirigés contre lui.
Voies intranasale, intra-tumorale
Des travaux de recherche chez l’animal ont évalué d’autres voies d’administration que musculaire, intradermique ou sous-cutanée. L’injection d’un vaccin prototype à ARN messager a notamment été effectuée directement dans des ganglions lymphatiques (voie intranodale), de même que par voie intraveineuse.
La voie intranasale, avec administration d’ARN messager par aérosols, a notamment été utilisée chez la souris pour générer des anticorps anti-VIH (recherche d’une immunité mucosale).
De même, pour lutter contre le cancer, l’administration d’un ARN messager par la voie intratumorale est à l’étude dans la mesure où cette stratégie pourrait tirer parti de la présence, au sein même d’une tumeur cancéreuse, de lymphocytes T résidents que l’on pourrait rapidement activer de façon spécifique.
Phénomène allergique
Une voie d’administration, en l’occurrence intraveineuse, a retenu l’attention des chercheurs pour ce qui concerne cette fois la tolérance des vaccins à ARN messager. En effet, l’administration par voie intraveineuse de nanoparticules peut rarement provoquer une réaction appelée pseudo-allergie liée à l’activation du « système du complément ». Celui-ci, composé d’un ensemble de protéines, est un acteur majeur du système immunitaire.
Cet effet secondaire, baptisé CARPA (Complement Activation-Related Pseudoallergy), est mentionné en avril 2020 dans la revue Current Topics in Microbiology and Immunology par Drew Weissman et Norbert Pardi, experts internationalement réputés pour leurs travaux sur les vaccins à ARN messager. La CARPA est également signalée comme éventuelle complication dans une publication de chercheurs belges de l’université de Gand parue en 2018 dans la revue Nanotoday.
Cette « pseudo-allergie » est un événement rare qui peut survenir lors de la première injection de liposomes ou autres nanoparticules, donc sans qu’il ait eu de sensibilisation antérieure. Cette réaction d’hypersensibilité, qui se manifeste par des symptômes cardiorespiratoires, a déjà été décrite après administration par voie intraveineuse de médicaments sous forme liposomale (produit de contraste en radiologie, traitement d’infections à levures, anticancéreux).
Le mécanisme exact de cette réaction immunologique indésirable, induite par les liposomes, fait toujours l’objet d’études dans la mesure où elle implique de nombreux types de cellules et molécules (dont des anaphylotoxines et autres substances habituellement libérées lors d’un choc anaphylactique). Deux paramètres propres aux liposomes pourraient être impliqués dans l’activation du système du complément, comme leur taille et la composition des excipients, qui influent sur la charge électrique de surface de ces nanoparticules lipidiques.
Quid d’une éventuelle génotoxicité ?
Autre élément à considérer en matière de vaccination par un acide nucléique, celui d’une éventuelle génotoxicité, sujet sur lequel des experts ont déjà émis des avis.
Le fait d’avoir recours à de l’ARN expose-t-il au risque de voir cet acide nucléique s’intégrer à l’ADN du noyau de la cellule ? En d’autres termes, une fois après avoir pénétré dans le cytoplasme, le plus souvent par l’intermédiaire de nanoparticules lipidiques ayant réussi à franchir la barrière représentée par la membrane externe, l’ARN pourrait-il pénétrer dans le noyau ?
Drew Weissman et Norbert Pardi abordent cette question dans un ouvrage intitulé DNA Vaccines (Humana Press, avril 2020). Selon eux, l’ARN n’a aucun moyen connu lui permettant de s’intégrer dans l’ADN, à moins qu’il ne soit préalablement « rétrotranscrit » en ADN. Ces experts soulignent que cette possibilité, théorique, nécessiterait que la cellule possède l’enzyme transcriptase inverse, capable de copier l’ARN en ADN, comme lors de l’infection par un rétrovirus (par exemple, le virus du sida) ou à partir de séquences d’ADN correspondant à des éléments transposables (rétrotransposons).
Cette hypothèse impliquerait donc forcément la survenue d’une étape supplémentaire, jugée improbable, et ce d’autant plus que tout ARN est rapidement dégradé après avoir été traduit en protéine. Même si la copie ADN de l’ARN s’intégrait dans le génome, elle serait de tout façon dépourvue des séquences lui permettant de provoquer une surexpression de gènes à proximité du site d’intégration, soulignent les chercheurs. Et de conclure que des recherches sont nécessaires pour déterminer si une intégration de l’ARN dans le génome pourrait se produire en cas d’infection rétrovirale.
Les ARN messagers conventionnels, tout comme les ARN messagers auto-réplicatifs, ne peuvent donc pas, en principe, intégrer le génome de la cellule. La vaccination par un ARN messager ne s’apparente donc nullement à de la thérapie génique, approche consistant à délivrer dans l’ADN un gène « sain » pour suppléer au gène « malade ».
Vaccins anti-cancer
C’est dans le domaine de la lutte contre le cancer que l’on dispose du plus grand recul sur les vaccins à ARN messager. L’objectif est de concevoir une immunothérapie anti-cancéreuse dans laquelle l’ARN messager est le médicament. Ces vaccins sont à visée thérapeutique et non prophylactique. En d’autres termes, ils ne visent pas à prévenir mais à soigner.
Les vaccins prototypes anti-cancer à base d’ARN messager portent le code de fabrication de protéines particulièrement ou exclusivement exprimées par des cellules tumorales, ce que l’on appelle des « antigènes associés aux tumeurs » qui peuvent être libérés dans le sang ou rester à la surface de la cellule. L’objectif, en faisant directement produire par le patient un antigène tumoral, est de stimuler son système immunitaire afin de l’aider à éliminer les cellules cancéreuses ou freiner le développement de la tumeur.
La protéine codée par un vaccin anti-cancer à ARN messager peut être la protéine entière ou un fragment (épitope) de celle-ci, que le système immunitaire aura toutes les chances de reconnaître comme un intrus. Plus précisément, l’objectif de tels vaccins est de stimuler la production de lymphocytes T cytotoxiques (CTL), autrement dit de lymphocytes T tueurs, capables de détruire les cellules tumorales exprimant l’antigène codé par l’ARN messager. De nombreux essais, chez l’animal et chez l’homme, ont montré l’intérêt de cette approche pour combattre certains cancers.
L’histoire des vaccins anti-cancer à ARN messager a commencé en 1995. Robert M. Conrey et ses collègues de l’université de Birmingham (Alabama) rapportent dans la revue Cancer Research que l’injection intramusculaire d’un ARN codant un antigène tumoral induit une réponse en anticorps spécifiques de cet antigène. Celui-ci est l’antigène carcino-embryonnaire (ACE), protéine qu’on détecte normalement en très faibles quantités chez l’adulte mais qu’on détecte en quantité élevée dans le sang de certains patients atteints de cancer.
Un an plus tard, en 1996, David Boczkowski et ses collègues de la Duke University (Caroline du Nord) introduisent in vitro dans des cellules dendritiques un ARN messager codant un antigène, voire un grand nombre d’ARN provenant d’extraits de cellules tumorales. Injectées par voie sous-cutanée à des souris, ces cellules dendritiques se révèlent efficaces pour inhiber la croissance de tumeurs chez l’animal.
Ces résultats vont contribuer à l’accélération des recherches sur l’utilisation de vaccins à ARN messager contre le cancer, d’autant que l’on continue parallèlement de découvrir de nouveaux antigènes tumoraux.
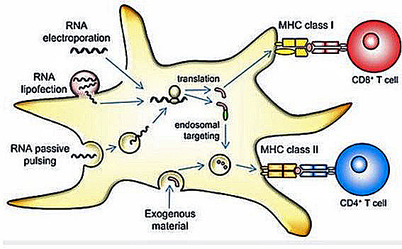
En 2002, un essai clinique est entrepris chez l’homme pour évaluer la sécurité, la tolérance et l’efficacité d’un vaccin anti-cancer à ARN messager dans le traitement du cancer de la prostate métastatique. Le vaccin prototype consiste en l’injection de cellules dendritiques dans lesquelles on a introduit l’ARN messager codant l’antigène PSA. Mené sur treize patients, cet essai a donné des résultats encourageants chez trois d’entre eux (élimination transitoire des cellules tumorales circulantes). Pour aider l’ARN à pénétrer à l’intérieur des cellules dendritiques, ces dernières ont subi un choc électrique à haut voltage qui a permis de perméabiliser leur membrane externe. Cette technique, dite de l’électroporation, sera par la suite utilisée pour introduire dans les cellules dendritiques, outre l’ARN messager, d’autres molécules permettant de mieux stimuler ces cellules présentatrices d’antigène.
En 2008, les résultats du premier essai clinique d’un vaccin à base d’ARN chez des patients souffrant de mélanome malin sont publiés.
Depuis, des améliorations ont régulièrement été rapportées. Des équipes ont utilisé un ARN messager codant un cocktail de trois molécules pour optimiser la fonction des cellules dendritiques et les rendre plus efficaces pour stimuler les lymphocytes. Cet ARN a été associé dans des cellules dendritiques à un second ARN messager codant un antigène associé au mélanome malin. Ces cellules ont été administrées à des patients souffrant d’une forme avancée de mélanome, entraînant une régression de la tumeur d’environ 27 %.
De nombreuses voies d’administration ont été évaluées dans de nombreux modèles animaux de cancer : intradermique, intramusculaire, sous-cutanée, intraveineuse et même intranasale. L’ARN messager a également été injecté directement dans la rate, organe lymphoïde riche en cellules dendritiques (injection intrasplénique) ou dans des ganglions lymphatiques (voie intranodale).
Les succès obtenus dans ces études chez l’animal ont permis d’entreprendre des essais cliniques chez l’homme. Le plus souvent, ces derniers ont consisté en l’utilisation d’ARN messager introduit dans des cellules dendritiques. Ils ont concerné de nombreux types de tumeurs : cancer de la prostate métastatique, du poumon métastatique, du rein, du pancréas, de l’ovaire, du côlon, de même que diverses tumeurs cérébrales (glioblastome, gliome malin, métastases cérébrales), le mélanome, la leucémie aiguë myéloïde, pour n’en citer que quelques-uns.
Schéma illustrant le concept de vaccination thérapeutique anti-cancéreuse à base d’ARN messager introduit dans des cellules dendritiques. 1 : biopsie tumorale, identification d’antigène tumoral d’intérêt, production d’ARN messager. 2 : transfection de cellules dendritiques (incorporation de l’ARN messager dans ces cellules présentatrices d’antigène). 3 : injection des cellules dendritiques transfectées dans le but d’induire une réponse immunitaire. 5 : attaque de la tumeur par des lymphocytes T activés, spécifiques de l’antigène tumoral. Dörrie J, et al. Pharmaceutics. 2020 Jan 23;12(2):92.
Sachant que pour un même type de cancer, la nature des mutations présentes dans la tumeur peut différer d’un patient à l’autre, il est apparu intéressant de développer des traitements personnalisés. Il est en effet possible de séquencer le génome de la tumeur d’un patient et d’identifier des mutations spécifiques du cancer. Parmi celles-ci, certaines sont susceptibles, lorsqu’elles sont introduites dans un ARN messager administré au patient, de déclencher une réaction du système immunitaire qui sera spécifiquement dirigée contre la tumeur. On parle de mutations immunogènes.
La molécule d’ARN messager s’avère donc une stratégie thérapeutique personnalisée dans la mesure où elle devient un médicament conçu en tenant compte des caractéristiques génétiques de la tumeur du patient. Le séquençage complet de la tumeur d’un patient pourrait donc permettre de produire un ou plusieurs ARN messagers entrant dans la composition d’une immunothérapie anti-cancéreuse personnalisée. Dans ce domaine, les premiers résultats encourageants chez l’homme ont été publiés en 2017 dans la revue Nature par BioNTech, en l’occurrence chez des patients atteints de mélanome.
La firme allemande a depuis développé une plateforme de production d’ARN messagers codant des antigènes tumoraux fréquemment rencontrés ainsi que des antigènes uniquement exprimés chez des patients porteurs de tumeurs hébergeant des mutations spécifiques.
En juillet 2020, des chercheurs de BioNTech ont rapporté dans la revue Nature l’administration par voie intraveineuse à des patients souffrant de mélanome malin d’un ARN messager encapsulé dans des liposomes. Cet ARN messager code quatre antigènes tumoraux fréquemment présents dans ce cancer cutané.
Des résultats cliniques encourageants (réponse partielle) ont été obtenus lorsque cet ARN messager a été administré seul ou en association avec une autre forme d’immunothérapie anticancéreuse (par inhibiteurs de points de contrôle immunitaire ou immune checkpoint inhibitors).
D’autres équipes internationales sont également sur les rangs. Leur stratégie repose également sur l’administration de cellules dendritiques dans lesquelles un ARN messager a été introduit. Des chercheurs du Memorial Sloan Kettering Cancer Center (New York) et de l’hôpital norvégien du radium (Oslo) poursuivent cette piste dans le mélanome. L’hôpital universitaire d’Oslo travaille sur cette même approche dans le cancer de la prostate. Enfin, des vaccins anti-cancer à ARN sont à l’étude pour combattre d’autres tumeurs malignes. Des travaux sont actuellement conduits au Shangai Hospital et Stemirna Therapeutics en Chine, à l’hôpital universitaire de Tübingen (Allemagne), ainsi que par la société américaine AlphaVax (Duke University).
Vaccins à ARN messager et maladies infectieuses
Bien que moins nombreux que ceux visant à combattre le cancer, des vaccins prototypes à base d’ARN messager ont également été utilisés pour prévenir une infection. Il est en effet plus facile de juger de l’efficacité d’un vaccin contre un agent infectieux que contre une pathologie tumorale mais également du fait qu’un vaccin à ARN messager peut également être produit bien plus rapidement qu’un vaccin conventionnel.
En infectiologie, tout a commencé deux ans plus tôt que les premiers travaux en oncologie. C’est en effet en 1993 que Frédéric Martinon, Pierre Meulien et leurs collègues de l’Inserm, de l’Institut Cochin de génétique moléculaire et de Pasteur Mérieux Sérums et Vaccins (Marcy-l’Étoile) ont montré qu’un liposome renfermant un ARN messager codant une protéine du virus de la grippe induit chez la souris une réponse immunitaire cellulaire (lymphocytes T). Depuis, des vaccins prototypes à ARN messager ont été développés contre plusieurs virus, bactéries et parasites.
De nombreux travaux sur les vaccins à base d’ARN ont été consacrés à l’infection par le virus de la grippe (virus influenza). C’est en 2012 que Benjamin Petsch et ses collègues du Friedrich-Loeffler-Institut (Tübingen) rapportent qu’un vaccin ARN messager est capable de conférer une protection contre le virus influenza. Sa capacité à induire une réponse immunitaire, chez la souris, des furets et des porcs, était comparable à celle observée avec un vaccin grippal inactivé conventionnel.
En 2018, Annette B. Vogel et ses collègues de BioNTech (Mayence, Allemagne) montrent qu’un ARN messager, non modifié, peut induire la synthèse in vivo chez la souris d’une protéine 12 à 24 heures après une injection intramusculaire, avec un pic d’expression au 8ème jour.
Alors que la mise au point d’un virus conventionnel contre le virus grippal prend environ six mois, des chercheurs ont mis huit jours en 2013 pour produire un virus ARN messager anti-influenza après que la séquence génétique de deux gènes importants (hémagglutinine et neuraminidase) du virus H7N9, responsable d’une épidémie de grippe aviaire en Chine, ait été rendue publique.
L’infection par le VIH a également fait l’objet d’intenses recherches. La stratégie a consisté à introduire dans des cellules dendritiques un ARN messager codant des antigènes du VIH et à les injecter, par voie intradermique et/sous cutanée, à des patients atteints du sida et par ailleurs traités par antirétroviraux.
Plusieurs essais cliniques, canadiens, belges et néerlandais, ont été conduits. Le vaccin à ARN messager a entraîné une réponse immunitaire spécifique de l’antigène (lymphocytes T CD4 et CD8), mais sans pour autant observer de bénéfice clinique (pas de diminution de la charge virale). Des vaccins administrés par voie intraveineuse ont également été développés et de nombreuses formulations pour véhiculer le vaccin à l’intérieur de cellules ont été élaborées, sans parvenir à induire la production d’une réponse durable en anticorps neutralisants.
Des essais cliniques chez l’homme ont été conduits avec des vaccins à ARN messager porteurs de nucléotides modifiés, encapsulés dans des nanoparticules lipidiques et administrés par voie intramusculaire. Bien qu’encourageants, les taux d’anticorps obtenus n’atteignent pas le niveau de ceux observés chez l’animal.
Des efforts ont également été déployés pour développer un vaccin à ARN messager contre le virus Zika. Une équipe de la Perelman School of Medicine (université de Pennsylvanie, Philadelphie) a rapporté en 2017 dans la revue Nature que des réponses immunitaires puissantes et protectrices ont été obtenues par injection intradermique de faibles doses d’un ARN messager encapsulé dans des nanoparticules lipidiques chez des souris et des singes macaques rhésus. Chez ces derniers, l’ARN messager a été administré à de très faibles doses (50 microgrammes), ce qui correspond à une dose d’environ 0,02 milligramme par kilogramme de poids corporel. Un vaccin prototype est actuellement en essai clinique chez l’homme.
Des résultats prometteurs obtenus avec des vaccins à ARN messager chez l’animal, peuvent ne pas se voir confirmés lors d’essais cliniques chez l’homme, comme cela s’est vu lors de l’évaluation d’un vaccin contre la rage. Les résultats avaient pourtant été extrêmement prometteurs dans les modèles pré-cliniques. Ce vaccin à ARN messager (CureVac AG, Tübingen) avait en effet permis de protéger contre une injection mortelle de virus dans le cerveau de souris et d’induire une réponse, forte et durable, en anticorps neutralisants chez des porcs.
Une fois testé chez l’homme, ce vaccin n’a pas été à la hauteur des attentes. Des chercheurs allemands de l’université de Munich l’ont administré, par voie intradermique ou intramusculaire, dans les deux cas par une seringue à aiguille et par un dispositif sans aiguille (injecteur à haute pression).
Contre toute attente, lorsqu’il a été administré en injection par aiguille, le vaccin a échoué à induire une réponse en anticorps adéquate, et ce indépendamment de la dose ou de la voie d’administration. Seule l’injection sans aiguille a permis d’obtenir de meilleurs résultats, semblables à ceux obtenus chez l’animal. Les réponses immunitaires ont cependant décliné après un an de suivi. Résultat : le développement de ce candidat vaccin a été abandonné.
Par ailleurs, la plupart des sujets vaccinés avaient développé une réaction locale faible à modérée (douleur au point d’injection, douleurs musculaires, maux de tête, fatigue, frissons), principalement ceux qui avaient reçu le vaccin par voie intramusculaire. Trois personnes avaient rapporté la survenue de sévères réactions au site d’injection ou un syndrome pseudo-grippal.
Paralysie faciale idiopathique
Enfin, lors de cet essai clinique de phase I dont les résultats ont été publiés en 2017 dans The Lancet, un participant qui avait reçu la plus forte dose (640 microgrammes) d’un vaccin prototype contre la rage a développé une paralysie faciale modérée et transitoire. Il est possible que la forte immunogénicité intrinsèque de l’ARN messager ait pu jouer un rôle dans cet effet secondaire dans la mesure où ce type de paralysie faciale (paralysie faciale périphérique a frigore ou idiopathique) a été associée à une augmentation des taux d’interféron ou à un traitement par interféron [2].
La formulation du vaccin à ARN messager a depuis été optimisée, de même que sa séquence génétique. Les résultats obtenus avec ce nouveau ARN messager prototype, formulé dans des nanoparticules lipidiques, ont été satisfaisants. Un essai clinique de phase I a récemment débuté.
Des vaccins à ARN messager contre des souches de grippe aviaire (H10N8 et H7N9) ont également été développés, avec des résultats encourageants chez l’animal (souris, furets) mais mitigés dans les premiers essais cliniques chez l’homme.
Peu de vaccins à ARN messager ont été développés contre des infections bactériennes. Il s’agit principalement d’un vaccin codant un antigène du bacille tuberculeux (Mycobacterium tuberculosis) administré par voie intranasale et d’un vaccin contre le streptocoque (groupes A et B).
Il a été récemment montré qu’il est possible de produire un ARN messager codant non pas un seul antigène mais plusieurs antigènes et ainsi induire une réponse immunitaire efficace vis-à-vis de chacun d’entre eux. Il est donc possible de cibler un même agent infectieux sur plusieurs fronts. Cette stratégie a été développée contre le virus HSV-2, responsable de l’herpès génital, mais également contre le parasite de la toxoplasmose. Un vaccin ARN messager auto-réplicatif porteur de six antigènes a été développé, de même qu’un vaccin prototype contre le cytomégalovirus (CMV) codant cinq antigènes et actuellement en essai clinique de phase I.
Incorporer dans la molécule d’ARN plusieurs séquences codant des antigènes différents permet également de cibler simultanément plusieurs pathogènes. Une équipe du Massachusetts Institute of Technology a montré que six ARN auto-réplicatifs différents (réplicons) peuvent être encapsulés dans la même nanoparticule, chacun exprimant un antigène. Ce vaccin a induit une immunité protectrice contre ces six agents infectieux, notamment vis-à-vis du virus grippal H1N1, du parasite de la toxoplasmose (Toxoplasma gondii) et du virus Ebola. Le vaccin actuel contre le virus Ebola (rVSV-ZEBOV, souche Zaïre) est un vaccin vivant atténué recombinant. Constitué à partir virus de la stomatite vésiculaire (VSV), il est souvent responsable d’effets secondaires généraux.
Enfin, sur le front des maladies tropicales parasitaires, un vaccin ARN messager auto-réplicatif s’est montré capable chez la souris d’empêcher la réinfection par le parasite du paludisme. Un vaccin prototype contre la leishmaniose est également à l’étude.

jcomp © Freepik
Vaccins du futur ?
Ces dernières années ont donc été marquées par l’essor des travaux de recherche dans le domaine des vaccins à ARN messager. Ils ont montré la faisabilité de cette nouvelle approche vaccinale, particulièrement modulable selon le type d’antigène. En effet, elle permet d’élaborer le code de fabrication d’un antigène vaccinal d’intérêt dès lors que l’on dispose de la séquence génétique de l’agent infectieux. Il ne se sera écoulé que dix semaines entre le moment où la séquence du SARS-CoV-2 a été rendue publique et la participation des premiers volontaires inclus dans l’essai clinique conduit par Moderna.
Cette nouvelle modalité vaccinale permet également de rapidement produire cet antigène à l’échelle industrielle, ce qui en fait une méthode de vaccination particulièrement adaptée pour lutter contre une maladie infectieuse pandémique. Les plateformes de production peuvent ainsi fournir de très grandes quantités de vaccins à ARN à un coût inférieur à celui des vaccins conventionnels. Enfin, la séquence génétique codant l’antigène peut être rapidement modifiée si besoin.
Les données d’essais cliniques chez l’homme dans les champs de l’oncologie et des maladies infectieuses sont encourageantes. De nouveaux acteurs biopharmaceutiques (Genentech, Amgen, Merck) se sont depuis lancés dans ce champ de recherche. La vaccination utilisant l’ARN messager se révèle être une méthode prometteuse et attractive pour prévenir des maladies infectieuses ou traiter des pathologies cancéreuses. Que de chemin parcouru depuis la découverte de l’ARN messager en 1961 !
De nouvelles générations de vaccins à ARN messager sont d’ores et déjà à l’étude, qui intègrent les récents progrès réalisés dans les méthodes de production, de purification et de formulation de ces acides nucléiques. L’avenir des vaccins à ARN messager ne fait peut-être que commencer, même s’il est encore trop tôt pour pleinement évaluer le potentiel de cette nouvelle modalité vaccinale. En effet, des résultats très prometteurs obtenus dans des modèles animaux se sont parfois soldés par des déconvenues lors d’essais cliniques chez l’homme.
La mise au point de vaccins à ARN messager, tant en oncologie qu’en infectiologie, ne pourra que bénéficier d’une meilleure compréhension des mécanismes de la réponse immunitaire en cellules B et T. Elle dépendra en outre de la mise au point de systèmes, performants et sûrs, de livraison de l’ARN messager dans les cellules. Enfin, il s’agira, dans chaque cas, de déterminer la voie d’administration la plus efficace.
Marc Gozlan (Suivez-moi sur Twitter, sur Facebook)
[1] Les ribonucléases sont des enzymes présentes partout dans l’environnement, ce qui rend leur élimination très difficile. La congélation de l’ARN messager peut préserver cette molécule de l’action de ces enzymes. Le vaccin Pfizer doit être conservé à -70 °C, alors que celui de Moderna peut l’être à -20 °C pendant six mois, voire entre 4 et 8 °C pendant trente jours. On ignore le procédé qui permet au vaccin de Moderna de pouvoir être conservé à une température supérieure à celle du vaccin Pfizer.
[2] L’analyse de l’essai clinique de phase III du vaccin BNT162b2 de Pfizer-BioNTech a porté sur environ 38 000 participants, répartis selon un rapport 1:1 entre personnes ayant reçu le vaccin ou un placebo. Quatre cas de paralysie faciale idiopathique ont été notifiés dans le groupe vacciné (3, 9, 37 et 48 jours après la vaccination). Dans un premier cas survenu, la paralysie a été résolutive après trois jours (avec séquelle) ou persistante (pendant 10 à 21 jours). Aucun cas de paralysie faciale (Bell’s palsy) n’a été rapporté dans le groupe placebo. Les quatre cas dans le groupe vacciné ne représentent cependant pas une fréquence supérieure à ce qui est attendu dans la population générale. Pour le moment, on ne peut donc clairement conclure à une relation de cause à effet. Le comité vaccins de la FDA (Vaccines and Related Biological Products Advisory Committee, VRBPAC) recommande de surveiller l’éventuelle survenue de cas de paralysie de Bell lors de l’administration de ce vaccin à un plus grand nombre de personnes. Source : FDA. Mise à jour : Le 15 décembre, le VRBPAC a indiqué que, lors de l’essai clinique du vaccin mRNA-1273 de Moderna, trois cas de paralysie faciale (Bell’s palsy) sont survenus dans le groupe vacciné et un cas dans le groupe placebo. Source : FDA.
◄►◄►◄►◄►◄►
Pour faire simple
Le vaccin à ARN messager va introduire dans le cytoplasme des cellules (et non dans leur noyau contenant l'information génétique) une molécule d'ARN messager (un nucléotide) qui sera protégée par une gaine lipidique lui évitant d'être tout de suite dégradée par des enzymes : cela va permettre à certaines cellules de l'organisme de synthétiser une protéine ressemblant étrangement à celle présente sur les "spicules" du virus (vous savez, ces petites excroissances que l'on nous montre tout le temps sous forme schématisée). Cette protéine inoffensive va aller se loger à la surface des cellules, constituant ainsi un leurre et déclenchant la production d'anticorps. Toute infection ultérieure par le virus sera donc ainsi neutralisée.
Pour résumer
La recherche sur les vaccins à ARN messager a commencé en 1989. C'est donc effectivement un coup d'accélérateur extraordinaire qui a été donné depuis un an, avec des moyens humains et financiers énormes, qui permet aujourd'hui d'entamer le processus de vaccination d'une population mondiale estimée à quelques sept milliards et demi d'individus. Il faut savoir aussi que ce virus, tout comme les autres virus, ne sera jamais éradiqué mais qu'on pourra lutter contre lui.
Ca va prendre du temps !
 Tags : Le Monde, Sars-CoV-2, vaccin, ARN messager
Tags : Le Monde, Sars-CoV-2, vaccin, ARN messager
-
Commentaires